৯ম ও ১০ম শ্রেণির রসায়ন ৭ম অধ্যায় এর সৃজনশীল প্রশ্ন এবং উত্তর (SSC Chemistry)
আজকের আর্টিকেলে আমি নবম ও দশম শ্রেণির ৭ম অধ্যায় এর হ্যান্ড নোট দিয়ে দেবো। এখানে শুধুমাত্র সৃজনশীল প্রশ্ন এবং উত্তর থাকবে কিছু।
প্রশ্ন -1 : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
অপু ও সেতু উভয়ের বাসায় রান্নার কাজে প্রাকৃতিক গ্যাস ব্যবহার করা হয়। অপুর বাসার পাত্রের নিচে কালো দাগ পড়লেও সেতুর বাসার পাত্রের নিচে কোনো দাগ নেই।
ক. একমুখী বিক্রিয়া কাকে বলে?
খ. রাসায়নিক সাম্যাবস্থা বলতে কী বোঝায়?
গ. রান্নার সময় তাদের বাসায় সম্পন্ন বিক্রিয়াটি কোন ধরনের? ব্যাখ্যা কর।
ঘ. উদ্দীপকের কোন বাসায় রান্নার কাজে গ্যাসের অপচয় হয় বলে তুমি মনে কর? তোমার উত্তরের সপক্ষে যুক্তি দাও।
— 1নং প্রশ্নের উত্তর —
ক. যে বিক্রিয়ায় বিক্রিয়ক পদার্থ বা পদার্থসমূহ শুধু উৎপাদে পরিণত হয় এবং বিপরীত বিক্রিয়া করে উৎপাদ আর বিক্রিয়কে পরিণত হতে পারে না তাকে একমুখী বিক্রিয়া বলে।
খ. যে অবস্থায় কোনো উভমুখী বিক্রিয়ার সম্মুখ বিক্রিয়ার গতিবেগ বিপরীতমুখী বিক্রিয়ার গতিবেগের সমান হয় সে অবস্থাকে রাসায়নিক সাম্যাবস্থা বলে।
বিক্রিয়ার উভমুখিতার ফলে সাম্যাবস্থার উদ্ভব ঘটে। একটি উভমুখী বিক্রিয়ার শুরুতে সম্মুখ বিক্রিয়ার বেগ সবচেয়ে বেশি থাকে এবং বিপরীত বিক্রিয়ার বেগ কম থাকে। সময়ের সঙ্গে বিক্রিয়কের পরিমাণ কমতে থাকে ও উৎপাদের পরিমাণ বাড়তে থাকে। এক সময় সম্মুখ ও বিপরীত বিক্রিয়ার বেগ সমান হয়। এ অবস্থাকে বলে রাসায়নিক সাম্যাবস্থা।
গ. রান্নার সময় তাদের বাসার সম্পন্ন বিক্রিয়াটি হলো দহন বিক্রিয়া।
অপু ও সেতুর বাসায় গ্যাসের চুলায় প্রাকৃতিক গ্যাস ব্যবহার করা হয়। অর্থাৎ প্রাকৃতিক গ্যাস জ্বালিয়ে বা পুড়িয়ে যে তাপশক্তি পাওয়া যায় তা দিয়ে রান্নার কাজ করা হয়।
রান্নার সময় প্রাকৃতিক গ্যাস অর্থাৎ মিথেনের দহন ঘটে, যা নিম্নোক্ত সমীকরণের সাহায্যে দেখানো যেতে পারে-
CH4(g) + O2(g) → CO2(g) + H2O(g) + তাপ
যেহেতু বিক্রিয়ায় তাপ উৎপন্ন হয় তাই এটি একটি তাপ উৎপাদী বিক্রিয়া। এই বিক্রিয়ায় বায়ুর অক্সিজেনের উপস্থিতিতে মিথেনকে পুড়িয়ে তাপ পাওয়া যায় বলে একে দহন বিক্রিয়া বলে।
ঘ. অপুর বাসায় রান্নার কাজে প্রাকৃতিক গ্যাসের অপচয় হয়।
প্রাকৃতিক গ্যাসের প্রধান উপাদান হলো মিথেন (CH4)। মিথেনকে পুড়িয়ে বা দহন করে প্রচুর তাপ পাওয়া যায়, যা রান্নাসহ অন্যান্য কাজে ব্যবহার করা হয়। এক্ষেত্রে নিম্নরূপ বিক্রিয়া ঘটে :
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + তাপ
এক্ষেত্রে প্রাকৃতিক গ্যাস তথা মিথেনের পূর্ণদহন ঘটে। কিন্তু অক্সিজেনের সরবরাহ কম হলে মিথেনের আংশিক দহনের ফলে কার্বন ডাইঅক্সাইডের পরিবর্তে কার্বন এবং কম তাপ উৎপন্ন হয়।
এক্ষেত্রে, নিম্নরূপ বিক্রিয়া ঘটে :
CH4(g) + O2(g) → ঈ(s) + 2H2O(g) + শক্তি
প্রাকৃতিক গ্যাস তথা মিথেনের অসম্পূর্ণ দহনের ফলে, উৎপন্ন কার্বন পাত্রের নিচে কালো দাগ হিসেবে জমা হয়। এ দাগ প্রাকৃতিক গ্যাসের অসম্পূর্ণ দহনকে নির্দেশ করে, যার ফলে প্রাকৃতিক গ্যাসের অপচয় ঘটে।
উদ্দীপক থেকে দেখা যায় যে, অপুর বাসায় পাত্রের নিচে কালো দাগ পড়লেও সেতুর বাসায় পাত্রের নিচে কোনো দাগ পড়ে না। কালো দাগ পড়ার মূল কারণ হলো প্রাকৃতিক গ্যাস বা মিথেনের অসম্পূর্ণ দহন। তাই বলা যায় যে, অপুর বাসায় রান্নার কাজে গ্যাসের অপচয় হয়।
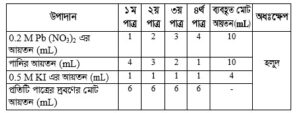
প্রশ্ন -2 : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
Pb (NO3)2 + 2KI-→
উপরের বিক্রিয়ার আলোকে নিচের ছকটি পূরণ করা হলো [K = 39, I= 127] :
ক. তাপোৎপাদী বিক্রিয়া কাকে বলে?
খ. যোজনী ও জারণ সংখ্যা এক নয় কেন? ব্যাখ্যা কর।
গ. সারণিতে ব্যবহৃত মোট KI এর পরিমাণ কত গ্রাম? নির্ণয় করে দেখাও।
ঘ. কোন পাত্রের দ্রবণটি অধিক হলুদ হবে বলে তুমি মনে কর? যুক্তিসহ ব্যাখ্যা কর।
— 2নং প্রশ্নের উত্তর —
ক. যে বিক্রিয়ায় বিক্রিয়ক থেকে উৎপাদ উৎপন্ন হওয়ার সময় তাপশক্তি উৎপন্ন হয় তাকে তাপোৎপাদী বিক্রিয়া বলে।
খ. কোনো মৌলের যোজনী বলতে অন্য মৌলের সাথে যুক্ত হওয়ার ক্ষমতাকে বোঝায়। আর জারণ সংখ্যা হলো ইলেকট্রন গ্রহণ বা বর্জনের ফলে সৃষ্ট তড়িৎচার্জের সংখ্যা।
যোজনী একটি বিশুদ্ধ সংখ্যা হলেও জারণ সংখ্যা ধনাত্মক বা ঋণাত্মক হতে পারে। জারণ সংখ্যা কখনো কখনো শূন্য হলেও যোজনী কখনোই শূন্য হয় না। আবার, জারণ সংখ্যা ভগ্নাংশ হতে পারে কিন্তু যোজনী সবসময়ই পূর্ণ সংখ্যা। এসব কারণেই জারণ সংখ্যা ও যোজনী এক নয়।
গ. সারণি থেকে দেখা যায়,
ব্যবহৃত KI এর মোট আয়তন = 4 mL
KI এর ঘনমাত্রা = ০.5M
KI এর আণবিক ভর = (39 + 127) gm = 166 gm = 1০০০ mL = 1 M KI এর ভর
∴ 1০০০ mL 1M KI এর ভর = 166 gm
4 mL ০.5 M KI এর ভর = (166 × 4 × ০.5gm)÷1০০০
= ০.332gm
∴ সারণিতে ব্যবহৃত KI এর মোট পরিমাণ = ০.332gm
ঘ. উদ্দীপকে সংঘটিত বিক্রিয়ার সমীকরণটি নিম্নরূপ :
Pb(NO3)2 + 2KI → 2KNO3 + PbI2 (হলুদ অধঃক্ষেপ)
সুতরাং, যে পাত্রে অধিক PbI2 উৎপন্ন হবে সেই পাত্রের দ্রবণ অধিক হলুদ হবে।
সারণি থেকে দেখা যায় যে, চারটি পাত্রের প্রত্যেকটিতে ০.5M 1 mL KI দ্রবণ নেয়া হয়েছে। কিন্তু প্রথম, দ্বিতীয়, তৃতীয়, চতুর্থ পাত্রে যথাক্রমে 1mL, 2mL, 3mL ও 4mL ০.2M Pb(NO3)2 দ্রবণ নেয়া হয়েছে।
Pb(NO3)2 এর আণবিক ভর
= 2০8 + (1৪ + 16 × 3) × 2 = 332
KI এর আণবিক ভর = (39 + 127) = 166
∴ ০.5 গ ষ mL KI দ্রবণে KI থাকে = (০.5×1×166)÷1০০০ গ্রাম
= ০.০83 গ্রাম
1ম পাত্রে,
০.2গ ষ mL Pb(NO3)2 দ্রবণে Pb(NO3)2 থাকে
= ০.2 × 1 × 332)÷1০০০ গ্রাম
= ০.০664 গ্রাম
2য় পাত্রে,
০.2গ 2mL Pb(NO3)2 দ্রবণে Pb(NO3)2 থাকে
= ০.2 × 2 × 332)÷1০০০ গ্রাম
= ০.1৩28 গ্রাম
3য় পাত্রে,
০.2গ 3mL Pb(NO3)2 দ্রবণে Pb(NO3)2 থাকে
= ০.2 × 3 × 332)÷1০০০ গ্রাম
= ০.1992 গ্রাম
4র্থ পাত্রে,
০.2গ 4mL Pb(NO3)2 দ্রবণে Pb(NO3)2 থাকে
= ০.2 × 4 × 332)÷1০০০ গ্রাম
= ০.2656 গ্রাম
যেহেতু, চতুর্থ পাত্রে Pb(NO3)2 এর পরিমাণ সবচেয়ে বেশি। তাই চতুর্থ পাত্রের দ্রবণটি অধিক হলুদ হবে।
প্রশ্ন -3 : নিচের বিক্রিয়াগুলো লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
(i) 2SO2(g) + O2(g) –→ 2SO3(g) ; ΔH = -197kJ/mole;
(ii) Zn + H2SO4 = ZnSO4 + H2
ক. মুদ্রা ধাতু কী? 1
খ. মোম এর দহন কোন ধরনের পরিবর্তন- ব্যাখ্যা কর। 2
গ. উদ্দীপকের (ii) নং বিক্রিয়াটি একটি জারণ-বিজারণ বিক্রিয়া ব্যাখ্যা কর। 3
ঘ. (i) নং বিক্রিয়ায় লা-শাতেলিয়ারের নীতির প্রয়োগ ব্যাখ্যা কর। 4
— 3নং প্রশ্নের উত্তর —
ক. পর্যায় সারণির গ্রুপ 11 তে অবস্থিত মৌল তামা (Cu), রুপা (Ag) ও সোনা (Au) কে মুদ্রা ধাতু বলা হয়।
খ. মোমের দহনে ভৌত ও রাসায়নিক উভয় পরিবর্তন সংঘটিত হয়।
মোমের প্রধান উপাদান বিভিন্ন হাইড্রোকার্বনের মিশ্রণ। মোম জ্বালালে তার কিছু অংশ শুধু ভৌত পরিবর্তনের মাধ্যমে গলে কঠিন অবস্থা থেকে তরল অবস্থায় রূপান্তরিত হয় এবং ঠাণ্ডা হয়ে পুনরায় কঠিন অবস্থায় পরিণত হয়। একইসাথে, মোমের কিছু অংশ অক্সিজেনের সাথে বিক্রিয়া করে কার্বন ডাইঅক্সাইড ও জলীয় বাষ্প তৈরি করে। সুতরাং, মোমের দহনে ভৌত এবং রাসায়নিক উভয় পরিবর্তন সংঘটিত হয়।
গ. উদ্দীপকে (ii) নং বিক্রিয়াটিতে বিক্রিয়াসমূহের মধ্যে ইলেকট্রনের আদান-প্রদান ও জারণ সংখ্যার হ্রাস-বৃদ্ধি ঘটে। কাজেই এটি একটি জারণ-বিজারণ বিক্রিয়া।
এক বা একাধিক বিক্রিয়ক থেকে নতুন যৌগ উৎপন্ন হওয়ার সময় বিক্রিয়ক বিদ্যমান মৌলসমূহের মধ্যে ইলেকট্রন আদান-প্রদান হলে ও বিক্রিয়ক পরমাণুর জারণ সংখ্যার হ্রাস বৃদ্ধি ঘটলে তাকে জারণ-বিজারণ বিক্রিয়া বলে।
উদ্দীপকের (ii) নং বিক্রিয়ায় Zn তথা ধাতব জিংক (দস্তা) H2SO4 এর সাথে বিক্রিয়া করে জিংক সালফেট ও হাইড্রোজেন গ্যাস উৎপন্ন হয়। এটি একটি জারণ-বিজারণ বিক্রিয়া। জারণ-বিজারণ বিক্রিয়ার দুটি অংশ- জারণ ও বিজারণ।
Zn + H2SO4 -→ ZnSO4 + H2
বিক্রিয়ায় আয়নিক রূপ :
Zn + H+ -→ Zn2+ + H2
উপরের বিক্রিয়ায় বিক্রিয়কে Zn-এর জারণ সংখ্যা শূন্য (০) এবং উৎপাদন ZnSO4 এ Zn- এর জারণ সংখ্যা +2। অর্থাৎ বিক্রিয়ায় Zn দুটি ইলেকট্রন অপসারণ করে জারিত হয় এবং ZnSO4 -এ পরিণত হয়। বিক্রিয়ার জারণ অংশকে নিম্নের সমীকরণের সাহায্যে উপস্থাপন করা হয়।
Zn – 2e–→ Zn2+
আবার, বিক্রিয়ক H2SO4 এ OH এর জারণ সংখ্যা +1 এবং উৎপাদে ঐ এর জারণ সংখ্যা শূন্য (০)। অর্থাৎ বিক্রিয়ায় H2SO4 দুটি ইলেকট্রন গ্রহণ করে বিজারিত হয় এবং OH এ পরিণত হয়। বিক্রিয়ার বিজারণ অংশকে নিম্নের সমীকরণের সাহায্যে উপস্থাপন করা হয়।
2H+ + 2e- -→ H2
বিক্রিয়ায় H2SO4 দুটি ইলেকট্রন গ্রহণ করে বিজারিত হয় এবং Zn কে জারিত করে। অর্থাৎ জারণ ও বিজারণ একইসাথে ঘটে।

অতএব, দেখা যাচ্ছে যে, উদ্দীপকের (ii) নং বিক্রিয়াটি একটি জারণ-বিজারণ বিক্রয়া।
ঘ. (i) নং বিক্রিয়াটি হলো-
2SO2 (g) + O2(g) -→ 2SO3 ; ΔH = -197/mole
উভমুখী হওয়ায় এ বিক্রিয়ার সাম্যাবস্থায় উৎপাদের পরিমাণ লা শাতেলিয়ারের নীতি দ্বারা নিয়ন্ত্রিত হয়।
লা শাতেলিয়ে নীতি অনুযায়ী, উভমুখী বিক্রিয়ার সাম্যাবস্থায় বিক্রিয়ার যেকোনো নিয়ামক (তাপমাত্রা/চাপ/বিক্রিয়কের ঘনমাত্রা) পরিবর্তন (হ্রাস/বৃদ্ধি) করলে বিক্রিয়ার সাম্যাবস্থা এমনভাবে পরিবর্তন হয় যেন নিয়ামক পরিবর্তনের ফলাফল প্রশমিত হয়।
উদ্দীপকের (i) বিক্রিয়ায় ΔH এর মান ঋণাত্মক। কাজেই এটি একটি তাপ উৎপাদী বিক্রিয়া।
এই উভমুখী বিক্রিয়াটির সম্মুখমুখী অংশটি তাপ উৎপাদী এবং বিপরীত বিক্রিয়াটি তাপহারী। এই বিক্রিয়ার সাম্যাবস্থায় তাপমাত্রা বৃদ্ধি করলে বিক্রিয়ার সাম্যাবস্থায় তাপমাত্রা বৃদ্ধি করলে বিক্রিয়ার সাম্যাবস্থা বাম দিকে অগ্রসর হয়ে বিক্রিয়কের অর্থাৎ SO2 ও O2 পরিমাণ বৃদ্ধি করবে। অর্থাৎ তাপহারী বিক্রিয়া বৃদ্ধির মাধ্যমে তাপ বৃদ্ধিজনিত ফলাফল প্রশমিত করবে। একইভাবে বিক্রিয়ার সাম্যবস্থায় তাপমাত্রা হ্রাস করলে সাম্যাবস্থা ডান দিকে অগ্রসর হবে। অর্থাৎ তাপউৎপাদী বিক্রিয়া বৃদ্ধি পাবে এবং উৎপাদ SO3 এর পরিমাণ বৃদ্ধি পাবে।
(i) নং বিক্রিয়ায় বিক্রিয়ক ছিল 3 অণু। কিন্তু উৎপাদ হয় 2 অণু। অর্থাৎ অণুর সংখ্যা হ্রাস পায়। ফলে একই আয়তনে চাপ হ্রাস পায়। বিক্রিয়ার সাম্যাবস্থায় চাপ বৃদ্ধি করলে সাম্যাবস্থা ডান দিকে অগ্রসর হয়। অর্থাৎ সম্মুখমুখী বিক্রিয়া বৃদ্ধির মাধ্যমে চাপ হ্রাস করবে এবং চাপ বৃদ্ধিজনিত ফলাফল প্রশমিত করবে। বিক্রিয়ার সাম্যবস্থায় চাপ হ্রাস করলে সাম্যাবস্থা বাম দিকে অগ্রসর হয়ে বিক্রিয়কের SO2 ও O2 এর পরিমাণ বৃদ্ধি করবে।
অতএব, উপরিউক্ত আলোPbা থেকে (i) নং বিক্রিয়ায় লা-শাতেলিয়ারের নীতির প্রয়োগ ব্যাখ্যা করা যায়।
প্রশ্ন-4 : (i) NaOH(aq) + HCl(aq) –→ NaCl(aq) + H2O(l);
(ii) 2Mg(s) + O2(g) –→2MgO(s);
(iii) N2(g) + 3H2(g) 2NH3(g) ; ΔH = -92 kJ.
ক. আকরিক কাকে বলে? 1
খ. পিঁপড়ার কামড়ের ক্ষতস্থানে চুন ব্যবহার করলে কোন ধরনের বিক্রিয়া ঘটে? ব্যাখ্যা কর। 2
গ. (i) ও (ii) নং বিক্রিয়ার মধ্যে কোনটি রিডক্স বিক্রিয়া? ব্যাখ্যা কর। 3
ঘ. উদ্দীপকের কোন বিক্রিয়ায় লা-শাতেলিয়ের নীতি প্রযোজ্য? বিশ্লেষণ কর। 4
— 4নং প্রশ্নের সমাধান —
ক যে সকল খনিজ থেকে লাভজনকভাবে ধাতু নিষ্কাশন করা যায়, তাদেরকে আকরিক বলে।
খ. পিঁপড়ার কামড়ের ক্ষতস্থানে চুন ব্যবহার করলে প্রশমন বিক্রিয়া ঘটে।
পিঁপড়ার কামড়ের ক্ষতস্থানে পিঁপড়ার শরীর থেকে যে বিষ প্রবেশ করে তাতে অ¤øীয় উপাদান থাকে। পিঁপড়ার কামড়ের জ্বালাযন্ত্রণা নিবারণ করার জন্য ক্ষতস্থানে চুন বা ক্যালসিয়াম অক্সাইড (CaO) ব্যবহার করা হয়। চুন একটি ক্ষারধর্মী পদার্থ, এটি অ¤øীয় উপাদানের সাথে প্রশমন বিক্রিয়া করে।
গ. (i) ও (ii) নং এ উল্লিখিত বিক্রিয়াদ্বয়ের মধ্যে (ii) নং বিক্রিয়াটি একটি রিডক্স বিক্রিয়া।
রিডক্স শব্দের অর্থ জারণ-বিজারণ। জারণ-বিজারণ বিক্রিয়া ইলেকট্রন স্থানান্তরের মাধ্যমে সংঘটিত হয়। দুটি বিক্রিয়কের মধ্যে জারণ-বিজারণ বিক্রিয়া সম্পন্ন হলে বিক্রিয়কের একাধিক মৌলের মধ্যে ইলেকট্রনের আদান-প্রদান হয়। অন্যদিকে ইলেকট্রনের আদান প্রদান না হলে তাকে নন-রিডক্স বিক্রিয়া বলে।
(i) নং বিক্রিয়াটি একটি প্রশমন বিক্রিয়া যাতে ইলেকট্রন আদান প্রদান হয় না। এতে হাইড্রোক্লোরিক এসিড (HCl) ও সোডিয়াম হাইড্রক্সাইড (NaOH) জলীয় দ্রবণে বিক্রিয়া করে সোডিয়াম ক্লোরাইড (NaCl) ও পানি (H2O) উৎপন্ন করে।
প্রকৃতপক্ষে বিক্রিয়ায় এসিডের হাইড্রোজেন আয়ন (H+) ও ক্ষারের হাইড্রোক্সিল আয়ন (OH-) যুক্ত হয়ে পানি উৎপন্ন করে। সোডিয়াম ক্লোরাইড জলীয় দ্রবণে সোডিয়াম আয়ন (Na+) ও ক্লোরাইড আয়ন (Cl-) হিসেবে থাকে। জলীয় দ্রবণে সোডিয়াম আয়ন (Na+) ও ক্লোরাইড আয়ন (Cl-) বিক্রিয়ায় অংশগ্রহণ করে না।
HCl(aq) + NaOH(aq) -→ Na+(aq) + Cl-(aq) + H2O(l)
অথবা,
H+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) -→ Na+(aq) + Cl-(aq) + H2O(l)
H+(aq) + OH-(aq) –→ H2O(l)
এ বিক্রিয়ায় কোনো ইলেকট্রনের স্থানান্তর ঘটে না।
অন্যদিকে, (ii) নং বিক্রিয়াটি – 2Mg + O2 –→ 2MgO(l)
2Mg – 4e- –→ 2Mg2+
O2 + 4e- –→ ঙ 2-2
অথবা, 2Mg – 4e- + O2 + 4e- –→ 2Mg2+O2-
দেখা যাচ্ছে যে, এ বিক্রিয়ায় ইলেকট্রন স্থানান্তর ঘটে।
অতএব, উপরিউক্ত ব্যাখ্যা ও সমীকরণসমূহ থেকে এটা স্পষ্টভাবে প্রতীয়মান হয় যে, (i) নং ও (ii) নং বিক্রিয়ার মধ্যে (ii) নং বিক্রিয়াটি রিডক্স বিক্রিয়া।
ঘ. উদ্দীপকে উল্লেখিত (ii) নং বিক্রিয়াটির ক্ষেত্রে লা-শাতেলিয়ের নীতি প্রযোজ্য।
উদ্দীপকের (iii) নং রাসায়নিক বিক্রিয়াটি হলো N2(g) + 3H2(g) 2NH3(g) ; ΔH = – 92kJ; এটি উভমুখী বিক্রিয়া।
লা-শাতেলিয়ের নীতি অনুসারে, উভমুখী বিক্রিয়ার সাম্যাবস্থায় যে কোনো একটি নিয়ামক (তাপমাত্রা/চাপ/বিক্রিয়কের ঘনমাত্রা) পরিবর্তন (হ্রাস/বৃদ্ধি) করলে বিক্রিয়ার সাম্যাবস্থা এমনভাবে পরিবর্তন হয় যেন নিয়ামকের পরিবর্তনের ফলাফল প্রশমিত হয়।
উদ্দীপকের উভমুখী বিক্রিয়াটির সম্মুখমুখী অংশটি তাপ উৎপাদী এবং বিপরীত বিক্রিয়াটি তাপহারী। এই বিক্রিয়ার সাম্যাবস্থায় তাপমাত্রা বৃদ্ধি করলে বিক্রিয়ার সাম্যাবস্থা বামদিকে অগ্রসর হয়ে বিক্রিয়কের অর্থাৎ N2 ও H2 এর পরিমাণ বৃদ্ধি করবে এবং উৎপাদের অর্থাৎ অ্যামোনিয়ার (NH3) পরিমাণ হ্রাস করবে। অর্থাৎ, তাপহারী বিক্রিয়ার হার বৃদ্ধির মাধ্যমে তাপ বৃদ্ধিজনিত ফলাফল প্রশমিত করবে।
আবার, বিক্রিয়াটির উৎপাদে বিক্রিয়কের তুলনায় অণুর সংখ্যা হ্রাস পায়। ফলে, একই আয়তনে চাপ হ্রাস পায়। বিক্রিয়ার সাম্যাবস্থায় চাপ বৃদ্ধি করলে সাম্যের অবস্থান ডানদিকে অগ্রসর হয়। অর্থাৎ, সম্মুখমুখী বিক্রিয়া বৃদ্ধির মাধ্যমে চাপ হ্রাস করবে এবং চাপ বৃদ্ধিজনিত ফলাফল প্রশমিত করবে। ফলে অ্যামোনিয়ার (NH3) উৎপাদন বৃদ্ধি পাবে।
প্রশ্ন -5 : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
Zn + H2SO4 ZnSO4 + H2.
ক. সমাণুকরণ বিক্রিয়া কাকে বলে? 1
খ. উভমুখী বিক্রিয়া বলতে কী বোঝ? 2
গ. উৎপাদ যৌগটিতে সালফারের জারণ সংখ্যা নির্ণয় কর। 3
ঘ. উদ্দীপকে উল্লিখিত বিক্রিয়াটিতে জারণ-বিজারণ যুগপৎ ঘটে- বিশ্লেষণ কর। 4
:ল্প 5নং প্রশ্নের উত্তর :ল্প
ক. কোনো রাসায়নিক বিক্রিয়ায় যৌগের পরমাণুসমূহের পুনর্বিন্যাসের মাধ্যমে একটি সমানু থেকে অপর সমানু উৎপন্ন হলে তাকে সমানুকরণ বিক্রিয়া বলে।
খ. যে বিক্রিয়ায় বিক্রিয়ক পদার্থসমূহ বিক্রিয়া করে উৎপাদে পরিণত হয়, একই সাথে উৎপন্ন পদার্থসমূহ ভেঙে পুনরায় বিক্রিয়কে পরিণত হয়, তাকে উভমুখী বিক্রিয়া বলে।
উভমুখী বিক্রিয়ায় একই সাথে দুটি বিক্রিয়া চলমান থাকে। একটি বিক্রিয়ায় বিক্রিয়কসমূহ বিক্রিয়া করে উৎপাদে পরিণত হয়, একে সম্মুখমুখী বিক্রিয়া বলে। অপরটিতে বিক্রিয়ায় উৎপন্ন পদার্থসমূহ বিক্রিয়া করে বিক্রিয়কে পরিণত হয়, একে বিপরীতমুখী বিক্রিয়া বলে। উভমুখী বিক্রিয়ার ক্ষেত্রে বিক্রিয়ক ও উৎপাদের মধ্যে উভমুখী তীর চিহ্ন (খ) ব্যবহার করে বিক্রিয়ার সমীকরণ উপস্থাপন করা হয়।
গ. উৎপাদ যৌগটি হলো জিংক সালফেট ZnSO4 । এতে সালফারের জারণ সংখ্যা পরিবর্তনশীল। যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্মক আয়ন উৎপন্ন করে অথবা যত সংখ্যক ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়ন উৎপন্ন করে তাকে মৌলের জারণ সংখ্যা বলে।
ধরি, সালফারের জারণ সংখ্যা = ী
জিংকের জারণ সংখ্যা = +2
অক্সিজেনের জারণ সংখ্যা = -2
নিরপেক্ষ যৌগে পরমাণুসমূহের মোট জারণ সংখ্যা শূন্য হয়।
অর্থাৎ ZnSO4 -এ,
2(+2) + ী + 4(-2) = ০
বা, 4 + ী – 8 = ০
বা, ী – 4 = ০
∴ ী = + 4
∴ উৎপাদ যৌগ ZnSO4 – এ সালফারের জারণসংখ্যা + 4।
ঘ. সৃজনশীল 4(ঘ) নং উত্তর দ্রষ্টব্য।
প্রশ্ন-6 : Zn + H2SO4 → ZnSO4 + H2
ক. মরিচা কী? 1
খ. নিঃসরণ বলতে কী বুঝ? 2
গ. উৎপাদ যৌগটিতে সালফারের জারণ সংখ্যা নির্ণয় কর। 3
ঘ. উদ্দীপকের বিক্রিয়াতে জারণ-বিজারণ যুগপৎ ঘটে-বিশ্লেষণ কর। 4
— 6নং প্রশ্নের সমাধান —
ক বিশুদ্ধ লোহা জলীয়বাষ্পের উপস্থিতিতে বায়ুর অক্সিজেনের সাথে রাসায়নিক বিক্রিয়ার মাধ্যমে লোহার অক্সাইড নামক যে পদার্থে পরিণত হয়, তাকে মরিচা বলে।
খ. সরু ছিদ্রপথে কোনো অণুসমূহের উচ্চচাপ থেকে নিম্নচাপ অঞ্চলে বেরিয়ে আসার প্রক্রিয়াকে নিঃসরণ বলে।
একটি পাকা কাঁঠাল Niের একটি কক্ষে রেখে দিলে তার গন্ধ কাঁঠালের ত্বকের ছিদ্রপথে বের হয়ে বিভিন্ন কক্ষে ছড়িয়ে পড়ে। ত্বকের ছিদ্রপথে গন্ধ বের হয়ে আসাকে বলে নিঃসরণ। নিঃসরণ বস্তুর ভর এবং ঘনত্বের উপর নির্ভরশীল।
গ. উদ্দীপকের উৎপাদ যৌগটি হলো ZnSO4 তথা জিংক সালফেট।
যৌগ গঠনের সময় কোনো মৌল যত সংখ্যক ইলেকট্রন বর্জন করে ধনাত্মক আয়ন উৎপন্ন করে অথবা যত সংখ্যক ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়ন উৎপন্ন করে তাকে মৌলের জারণ সংখ্যা বলে।
ZnSO4 -এ ঝ-এর জারণ সংখ্যা = ী
জিংক (Zn)-এর জারণ সংখ্যা = + 2 এবং
অক্সিজেন (ঙ)-এর জারণ সংখ্যা= – 2
∵ ZnSO4 নিরপেক্ষ অণু, অতএব পরমাণুসমূহের মোট জারণ সংখ্যা শূণ্য হয়।
সুতরাং, (+2) + ী + (-2) × 4 = ০
বা, ী – 6 = ০
∴ ী = + 6
∴উদ্দীপকের উৎপাদ ZnSO4 যৌগটিতে সালফারের জারণ সংখ্যা + 6।
ঘ. সৃজনশীল প্রশ্ন 4 (গ) নং উত্তর দেখ।
প্রশ্ন -7 : (i) 2FeCl2 + SnCl4 → 2FeCl3 + SnCl2
(ii) 2Na + Cl2 → 2NaCl
ক. প্রতিস্থাপন বিক্রিয়া কী? 1
খ. বোর পরমাণু মডেলের 2টি সীমাবদ্ধতা লিখ। 2
গ. (ii) নং বিক্রিয়াটিতে কোনটি জারক ও বিজারক চিহ্নিত কর। 3
ঘ. (i) নং বিক্রিয়াটিতে জারণ ও বিজারণ একই সাথে সংঘটিত হয় ব্যাখ্যা কর। 4
— 7নং প্রশ্নের উত্তর —
ক. কোনো যৌগের একটি মৌল বা যৌMgূলককে অপর কোনো মৌল বা যৌMgূলক দ্বারা প্রতিস্থাপন করে নতুন যৌগ উৎপন্ন করার প্রক্রিয়ার নাম প্রতিস্থাপন বিক্রিয়া।
খ. বোর পরমাণু মডেলের 2টি সীমাবদ্ধতা হলো :
1. বোর পরমাণু মডেল হাইড্রোজেন ও হাইড্রোজেন সদৃশ এক ইলেকট্রনবিশিষ্ট আয়ন বা আয়নসমূহের বর্ণালি ব্যাখ্যা করতে পারলেও একাধিক ইলেকট্রনবিশিষ্ট পরমাণুসমূহের বর্ণালি ব্যাখ্যা করতে পারে না।
2. এক শক্তিস্তর হতে অপর শক্তিস্তরে ইলেকট্রনের স্থানান্তর ঘটলে, বোর পরমাণু মডেল অনুসারে বর্ণালিতে একটি করে রেখা সৃষ্টি হওয়ার কথা। কিন্তু হাইড্রোজেন ও অন্যান্য পরমাণুসমূহের আয়নের রেখা-বর্ণালি অধিকতর সূ² যন্ত্র দ্বারা পরীক্ষণ করলে দেখা যায়, প্রতিটি রেখা কয়েকটি সূ² রেখায় বিভক্ত থাকে।
গ. উদ্দীপকের (ii) নং বিক্রিয়াটি হলো :
2Na + Cl2 → NaCl
বিক্রিয়ায় Na পরমাণু ইলেকট্রন ত্যাগ করে Na+ আয়নে পরিণত হয়।
Na – e- → Na+
বা, 2Na – 2e- → 2Na+
সেই ত্যাগকৃত ইলেকট্রন ক্লোরিন গ্যাস গ্রহণ করে Cl- আয়নে পরিণত হয়।
Cl2 + 2e- → 2Cl
এখানে Na জারিত হয় এবং Cl2 জারক।
অন্যদিকে Cl2 বিজারিত হয় এবং এক্ষেত্রে Na বিজারক।
ঘ. উদ্দীপকের (i) নং বিক্রিয়াটি হলো :
2FeCl2 + SnCl4 → 2FeCl3 + SnCl2
প্রদত্ত বিক্রিয়ায় স্টানাস আয়ন দুটি ইলেকট্রন ত্যাগ করে স্টানিক আয়নে পরিণত হয়।
Sn2+ – 2e- → Sn4+
অন্যদিকে Fe3+ আয়ন একটি ইলেকট্রন গ্রহণ করে Fe2+ আয়নে পরিণত হয়।
Fe3+ + e- → Fe2+
অর্থাৎ দুটি Fe3+ আয়ন দুটি ইলেকট্রন গ্রহণ করে দুটি Fe2+ আয়নে পরিণত হয়।
2Fe3+ + 2e- → 2Fe2+
স্টানাস আয়ন কর্তৃক ত্যাগকৃত ইলেকট্রন দুটি ফেরিক আয়ন গ্রহণ করে। এখানে স্টানাস আয়ন জারিত হয় এবং এক্ষেত্রে ফেরিক আয়ন জারক। অপরদিকে, ফেরিক আয়ন বিজারিত হয় এবং স্টানাস আয়ন বিজারক।
উপরের আলোPbা থেকে বলা যায় যে, জারণ-বিজারণ বিক্রিয়া একই সাথে সংঘটিত হয়।
প্রশ্ন -8 : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
চারটি টেস্টটিউব বা স্বচ্ছ কাচের গøাস নাও এবং এগুলোকে 1, 2, 3 ও 4 নম্বর দিয়ে চিিহ্নত কর। প্রতিটি টেস্টটিউবে সমপরিমাণ আনুমানিক ০.5/1 মি.গ্রাম সোডিয়াম কার্বোনেট (Na2CO3) অথবা কাপড়কাচা সোডা নাও। অতঃপর 1 ও 2 নম্বর টেস্টটিউবে স্বাভাবিক পানি এবং 3 ও 4 নম্বর টেস্টটিউবে গরম পানি যোগ করে 2 ও 4 নম্বরে টেস্টটিউবে 1 মি.গ্রাম লেবুর রস অথবা ভিনেগার মিশ্রিত করে নিম্নলিখিত পরিবর্তনসমূহ পর্যবেক্ষণ কর।
ক. তাপ-উৎপাদী বিক্রিয়া বলতে কী বোঝ? 1
খ. পোকার কামড়ের জ্বালাযন্ত্রণা নিবারণে চুন ব্যবহার করলে উপশম হয় কেন? 2
গ. 2 ও 4 নম্বর টেস্টটিউবের কোনটিতে বেশি পরিমাণে গ্যাস নির্গত হয় এবং কেন? ব্যাখ্যা কর। 3
ঘ. ভিনেগারের পরিবর্তে বিশুদ্ধ অ্যাসিটিক এসিড ব্যবহার করলে কী ঘটবে বিশ্লেষণ কর। 4
— 8নং প্রশ্নের উত্তর —
ক. যে বিক্রিয়ায় বিক্রিয়ক থেকে উৎপাদ উৎপন্ন হওয়ার সময় তাপশক্তি উৎপন্ন হয় তাকে তাপ-উৎপাদী বিক্রিয়া বলে।
খ. পোকার কামড়ের ক্ষতস্থানে পোকার শরীর থেকে যে বিষ প্রবেশ করে তাতে অ¤øীয় উপাদান থাকে। মানুষ পোকার কামড়ের জ্বালাযন্ত্রণা নিবারণ করার জন্য ক্ষতস্থানে চুন ব্যবহার করে। চুন ক্ষারধর্মী পদার্থ। এটি অ¤øীয় উপাদানের সাথে প্রশমন বিক্রিয়া করে।
গ. চিত্রের 2 ও 4নং টেস্টটিউবে সংঘটিত রাসায়নিক বিক্রিয়াটি নিম্নরূপে প্রকাশ করা যায় :
Na2CO3 + CH3COOH -→ CH3COONa + CO2 + H2O
লেবুর রস/ভিনেগার
উল্লিখিত টেস্টটিউব দুটি থেকে উদ্ভূত বুদবুদ পর্যবেক্ষণ করে দেখা যায় যে একটি নির্দিষ্ট সময়ে (1 বা 5 মিনিট) টেস্টটিউবদ্বয়ে সমপরিমাণ CO2 গ্যাস নির্গত হয় না। এক্ষেত্রে 4নং টেস্টটিউবে নির্গত গ্যাসের পরিমাণ একই সময়ে 2নং টেস্টটিউবে থেকে নির্গত গ্যাসের পরিমাণের চেয়ে বেশি। এর কারণ হলো, 4নং টেস্টটিউবটিতে ঠাণ্ডা পানির পরিবর্তে গরম পানি দেয়া হয়েছিল। এতে দ্রবণের তাপমাত্রা বৃদ্ধি পায়। আর তাপমাত্রা বৃদ্ধি পেলে বিক্রিয়ক অণুসমূহের মধ্যে সংNi্ষ বৃদ্ধি পায়। অর্থাৎ তাপমাত্রা বৃদ্ধির কারণে বিক্রিয়ার হার বৃদ্ধি পায়। ফলে উৎপাদের পরিমাণ বৃদ্ধি পায়। তাই CO2 গ্যাস বেশি পরিমাণে নির্গত হয়।
অতএব, 4 নম্বর টেস্টটিউবে বেশি গ্যাস নির্গত হবে।
ঘ. ভিনেগারের পরিবর্তে বিক্রিয়ক হিসেবে বিশুদ্ধ অ্যাসিটিক এসিড ব্যবহার করলে বিক্রিয়ার হার বৃদ্ধি পাবে।
ভিনেগার হলো অ্যাসিটিক এসিডের 6 – 1০% জলীয় দ্রবণ। ভিনেগারের চেয়ে বিশুদ্ধ অ্যাসিটিক এসিডের ঘনমাত্রা বেশি। আর বিক্রিয়ার হার বিক্রিয়কের ঘনমাত্রার ওপর নির্ভরশীল। তাই বিশুদ্ধ অ্যাসিটিক এসিডের ঘনমাত্রা বেশি হওয়ার ফলে Na2CO3 অণুর সাথে বিশুদ্ধ CH3COOH অণুর সংNi্ষের পরিমাণ অনেক বৃদ্ধি পাবে।
তাই উৎপন্ন CO2 গ্যাসের পরিমাণ অনেক বৃদ্ধি পাবে এবং টেস্টটিউব থেকে বুদবুদ আকারে গ্যাস নির্গত হবে।
প্রশ্ন -9 : নিচের উদ্দীপকটি পড় এবং প্রশ্নগুলোর উত্তর দাও :
ঘটনা -1. একটি কাচের বিকারে কয়েক খণ্ড বরফ নিয়ে তাতে তাপ প্রয়োগ করা হলো।
ঘটনা -2. একটি মোমবাতি জ্বালিয়ে রাখা হলো। মোমের কিছু গলিত অংশ ঠাণ্ডা হয়ে জমে কঠিন অবস্থায় পরিণত হলো। এই প্রাপ্ত মোমের ভর মোমবাতির ভর অপেক্ষা কম।
ক. মোমের প্রধান উপাদান কী? 1
খ. রাসায়নিক পরিবর্তনে বিক্রিয়কের শতকরা সংযুতির পরিবর্তন ঘটে কেন? 2
গ. 1নং ঘটনাটি কোন ধরনের পরিবর্তনের? ব্যাখ্যা কর। 3
ঘ. 2নং ঘটনায় মোমের ভর হ্রাসের কারণ যুক্তিসহ ব্যাখ্যা কর। 4
— 9নং প্রশ্নের উত্তর —
ক. মোমের প্রধান উপাদান বিভিন্ন হাইড্রোকার্বনের মিশ্রণ।
খ. রাসায়নিক পরিবর্তনের ক্ষেত্রে এক বা একাধিক বিক্রিয়ক বিক্রিয়া করে নতুন পদার্থের সৃষ্টি হয় বলে তাদের শতকরা সংযুতির পরিবর্তন ঘটে।
যেহেতু রাসায়নিক পরিবর্তনে নতুন পদার্থের সৃষ্টি হয়, তাই নতুন পদার্থের আণবিক সংকেত বিক্রিয়ক থেকে ভিন্ন হবে। সুতরাং, রাসায়নিক পরিবর্তনে বিক্রিয়কের শতকরা সংযুতির পরিবর্তন হয়।
গ. 1নং ঘটনাটি ভৌত পরিবর্তন।
কোনো পদার্থের শতকরা সংযুতির পরিবর্তন না হলে যে পরিবর্তন হয় তাকে ভৌত পরিবর্তন বলে।
বরফকে তাপ দিলে তা গলে পানিতে পরিণত হয়। এই পানি উত্তপ্ত হতে থাকলে 1০০0C তাপমাত্রায় বাষ্পে পরিণত হয়।
উদ্দীপকে শুরুতে পাত্রে বরফ থাকে। এই বরফে তাপ প্রয়োগের ফলে তা পানিতে পরিণত হয়। তাপ প্রয়োগ করতে থাকলে এই পানি 1০০0C তাপমাত্রায় জলীয় বাষ্পে পরিণত হয়। তাই কিছু সময় পর দেখা গেল বিকারে কিছু নেই। এখানে সংঘটিত পরিবর্তনটি নিম্নরূপ-
H2O(s) ঔ H2O(l) ঔ H2O(g)
যেহেতু এখানে শতকরা সংযুতির কোনো পরিবর্তন হচ্ছে না। সুতরাং, এটি ভৌত পরিবর্তন।
ঘ. 2নং ঘটনায় মোমের ভর হ্রাসের কারণ হলো রাসায়নিক বিক্রিয়া ও রাসায়নিক পরিবর্তন।
কোনো পদার্থ থেকে ভিন্ন সংযুতির পদার্থ উৎপাদনের প্রক্রিয়াকে রাসায়নিক পরিবর্তন বলে।
মোমবাতি জ্বালালে যে তাপ উৎপন্ন হয় তাতে মোমবাতির মোম গলে নিচে পড়তে থাকে এবং পরে ঠাণ্ডা হয়ে কঠিনে পরিণত হয়। আবার কিছুটা মোম অক্সিজেনের সাথে বিক্রিয়া করে।
কার্বন ডাইঅক্সাইড ও জলীয় বাষ্প উৎপন্ন হয়। এ বিক্রিয়ায় তাপ উৎপন্ন হয়।
ঈীঐু + ী + ু4 O2 -→ ীCO2 + ু2 H2O + শক্তি
এই উৎপন্ন তাপশক্তি বিক্রিয়াস্থলের মোমকে গলিয়ে তরলে পরিণত করে। এই তরল মোম নিচে পড়ে আবার শীতল হয়ে কঠিনে পরিণত হয়।
ধরা যাক, মোমবাতির মোমের ভর ছিল ী এবং 2 ঘণ্টা পরে প্রাপ্ত মোমের ভর ছিল ু। অবশ্যই ী এর মান ু এর মান অপেক্ষা বৃহত্তর হবে। কারণ কিছুটা মোমের রাসায়নিক পরিবর্তন হয়ে CO2 ও H2O(g) উৎপন্ন হয়েছে।
ধরি, ী – ু = ধ
সুতরাং, বলা যেতে পারে ধ পরিমাণ মোমের রাসায়নিক পরিবর্তন ঘটেছে বলেই মোমের ভর হ্রাস পেয়েছে।
প্রশ্ন -1০ : নিচের বিক্রিয়া দুটি লক্ষ কর এবং প্রশ্নগুলোর উত্তর দাও :
i. Zn + CuSO4 = ZnSO4 + Cu
ii. Fe + H2SO4 = FeSO4 + H2
ক. তাপহারী বিক্রিয়া কী? 1
খ. ঐ এর তাৎপর্য কী? 2
গ. উদ্দীপকের বিক্রিয়া দুটির বিপরীত বিক্রিয়া সম্ভব কিনা ব্যাখ্যা কর। 3
ঘ. (i) ও (ii) নং বিক্রিয়াতে জারণ ও বিজারণ একই সাথে ঘটেছে-বিশ্লেষণ কর। 4
— 1০নং প্রশ্নের উত্তর —
ক. যে বিক্রিয়াতে তাপ শোষিত হয় তাকে তাপহারী বিক্রিয়া বলে।
খ. ঐ এর তাৎপর্র্য হলো এটি দিয়ে রাসায়নিক বিক্রিয়ায় তাপের পরিবর্তন জানা যায়।
সাধারণত উৎপাদের তাপ থেকে বিক্রিয়কের তাপ বিয়োগ করে ঐ হিসাব করা হয়। এজন্য তাপ উৎপাদী বিক্রিয়ায় ঐ ঋণাত্মক এবং তাপহারী বিক্রিয়ায় ঐ ধনাত্মক হয়।
গ. উদ্দীপকের বিক্রিয়া দুটি হলো :
i. Zn + CuSO4 = ZnSO4 + Cu
ii. Fe + H2SO4 = FeSO4 + H2
সক্রিয়তা শ্রেণিতে Cu এর উপরে জিংকের অবস্থান। তাই Zn, Cu অপেক্ষা শক্তিশালী বিজারক। এজন্য (i) নং বিক্রিয়ায় Zn, Cu এর যৌগ থেকে Cu-কে প্রতিস্থাপন করতে পারে। কিন্তু বিপরীতভাবে Zn, Cu এর যৌগ থেকে জিংককে অপসারণ করতে পারে না।
Cu + ZnSO4 = ঘড় ৎবধপঃরড়হ
আবার, সক্রিয়তা শ্রেণিতে ঐ এর উপরে Fe এর অবস্থান। তাই Fe, ঐ অপেক্ষা শক্তিশালী বিজারক। (ii) নং বিক্রিয়ায় ঐ এর যৌগ থেকে ঐ-কে Fe দ্বারা প্রতিস্থাপন করা গেলেও বিপরীতভাবে Fe-এর যৌগ থেকে Fe-কে ঐ দ্বারা প্রতিস্থাপন সম্ভব নয়। এজন্য, i ও ii নং বিক্রিয়ার বিপরীত বিক্রিয়া সম্ভব নয়।
ঘ. (i) নং বিক্রিয়া হলো :
Zn + CuSO4 = ZnSO4 + Cu…… (ii)
বা, Zn + Cu2+ + SO4 2- = Zn2+ + SO4 2- + Cu
বা, Zn + Cu2+ = Zn2+ + Cu…… (iii)
এখন, Zn – 2e- = Zn2+ (জারণ)…… (রা)
Cu2+ + 2e- = Cu(বিজারণ)…… (া)
(রা) ও (া) নং যোগ করলে (iii) তথা (ii) নং সমীকরণটি পাওয়া যায়। অর্থাৎ এখানে জারণ-বিজারণ একই সাথে ঘটেছে। আবার, (ii) নং বিক্রিয়াটি হলো :
Fe + H2SO4 = FeSO4 + H2…… (ii)
বা, Fe + 2H+ + SO4 2- = Fe2+ + SO4 2- + H2
বা, Fe + 2H+ = Fe2+ + H2…… (ার)
এখন, Fe – 2e- = Fe2+ (জারণ)…… (াii)
2H+ + 2e- = 2H2(বিজারণ)…… (াiii)
(াii) ও (াiii) নং সমীকরণ দুটি যোগ করলে (ার) নং সমীকরণ তথা (ii) নং সমীকরণটি পাওয়া যায়। অর্থাৎ এখানে জারণ-বিজারণ একই সাথে ঘটেছে।
ইলেকট্রন ত্যাগ হলো জারণ এবং ইলেকট্রন গ্রহণ হলো বিজারণ। এই দুই প্রক্রিয়া উদ্দীপকের বিক্রিয়াদ্বয়ে একসাথে ঘটেছে। অর্থাৎ উভয় বিক্রিয়াতে জারণ-বিজারণ একই সাথে ঘটেছে।
N. B. উপরের প্রশ্নগুলো অনলাইন থেকে সংগ্রহ করে নেওয়া হয়েছে। সমাধান নামক ওয়েবসােইট থেকৈ সংগ্রহ করা হয়েছে সবগুলো প্রশ্ন এবং উত্তর।

.png)